Introdução
Os ruminantes são considerados menos suscetíveis ao efeito das micotoxinas em comparação com outras espécies. Os processos de biotransformação que ocorrem na microbiota ruminal convertem algumas dessas substâncias em compostos menos tóxicos para esses animais (Xu et al., 2023). No entanto, foi demonstrado que as micotoxinas continuam sendo prejudiciais para esta categoria animal e que a alteração do ambiente ruminal pode dificultar a detoxificação (Álvarez-Días et al., 2022).
Algumas micotoxicose causam doenças, agudas ou crônicas, com sinais clínicos e patologias evidentes. No entanto, é importante considerar que também podem provocar doenças subclínicas ou redução da produtividade, além de efeitos carcinogênicos, mutagênicos, teratogênicos, imunossupressores e endócrinos, que são difíceis de diagnosticar.
Essas doenças podem influenciar negativamente no desempenho e na produtividade dos ruminantes, causando problemas reprodutivos e desencadeando estados de imunossupressão (Álvarez-Días et al., 2022). Foi estabelecida uma correlação evidente entre a presença de micotoxinas na alimentação do gado leiteiro e a recusa alimentar, a redução na produção de leite, diarreias e infertilidade (Ismail et al., 2020). A descendência dos animais expostos a micotoxinas também é afetada. Em bovinos expostos a aflatoxinas, foi detectada uma prole mais suscetível a processos inflamatórios e infecções secundárias. Além disso, esse tipo de micotoxina causa danos hepáticos e renais (Álvarez-Días et al., 2022).
Aflatoxinas
As aflatoxinas representam um risco elevado para os ruminantes, especialmente para vacas leiteiras, devido à sua comprovada transferência para o leite destinado ao consumo humano ou à alimentação de bezerros (Hernandez-Valdivia et al., 2021). A aflatoxina B1 (AFB1) é a mais conhecida dentro dessa família, e entre os efeitos induzidos pela exposição aguda ou crônica destacam-se: fibrose hepática (cirrose) com proliferação de células dos ductos biliares, megalocitose, além de estase biliar e fígado hemorrágico (Imagem 1). Além disso, outros estudos documentaram que a exposição a essa micotoxina pode resultar em um fígado com textura bronzeada pálida (Imagem 2); fígado e coração congestos (Imagem 3) e rins hemorrágicos (Imagem 4) (Sajid Umar et al., 2015; Ismail et al., 2020; Álvarez-Días et al., 2022).
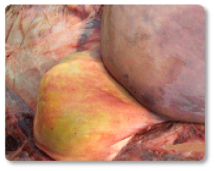
Imagem 1. Estase biliar e fígado hemorrágico.
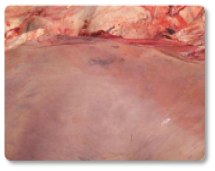
Imagem 2. Imagem 2. Fígado amarelado / pálido.
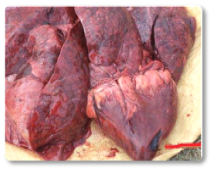
Imagem 3. Fígado e coração congestos
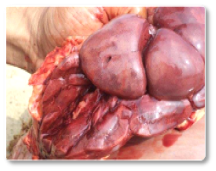
Imagem 4. Rins hemorrágicos.
Além disso, a AFB1 causa imunossupressão, aumentando a suscetibilidade a infecções secundárias e podendo afetar a produtividade (Riet-Correa et al., 2013). Os sintomas clínicos descritos incluem: inapetência, depressão, diarreia (Imagem 5) e epistaxe (Imagem 6) (Sajid Umar et al., 2015; Ismail et al., 2020; Álvarez-Días et al., 2022).

Imagem 5. Diarreia.
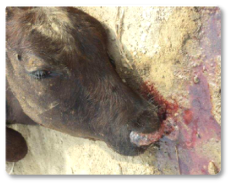
Imagem 6. Epistaxe.
Outros autores também descreveram abortos e aumento da mortalidade (Imagem 7), assim como prolapso (Imagem 8) (McKenzie et al., 1981; Van Halderen et al., 1988; Felipe Penagos-Tabares et al., 2024).

Imagem 7. Imagens de abortos aos 100 dias (A), 215 dias (B) et 260 dias (C) de gestação.
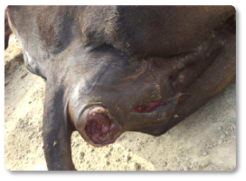
Imagem 8. Prolapso por aflatoxicose.
Zearalenona
Assim como em outras espécies, nos ruminantes, a zearalenona (ZEA) induz principalmente alterações reprodutivas. Seu efeito estrogênico pode gerar problemas de fertilidade, inflamação na vulva e alterações no ciclo reprodutivo (Hartinger et al., 2022). A produção de leite também é afetada por essa micotoxina, observando-se uma queda na quantidade de litros produzidos, assim como uma alteração na sua qualidade (Ogunade et al., 2018). Essa micotoxina pode desencadear problemas significativos também nos machos. Alguns autores descreveram casos de esterilidade causados por seu efeito oxidativo (Liu et al., 2023). A zearalenona também causa danos no fígado e nos rins, assim como edemas pulmonares (Hartinger et al., 2022). Além disso, foram descritos casos de prolapso retal (Imagem 9), aumento da vulva e prolapso uterino em vacas não gestantes (Imagem 10).

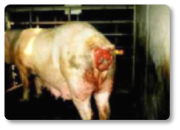
Imagem 9. Prolapso retal.
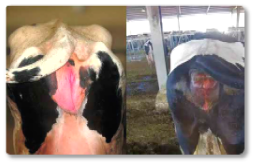
Imagem 10. Aumento da vulva e prolapso uterino em vacas não gestantes.
Deoxinivalenol
Os ruminantes que não apresentam nenhuma alteração metabólica ou processo inflamatório são capazes de inativar quantidades significativas de deoxinivalenol (DON). No entanto, a microbiota ruminal pode ser afetada em casos de fermentação alterada e/ou baixo pH ruminal (Whitlow e Hagler, 2007). Em situações de alta contaminação dos alimentos, exposição prolongada ou defesas comprometidas, o DON pode reduzir a ingestão de matéria seca, comprometer a reprodução e alterar o sistema imunológico (Guerrero-Netro et al., 2021). Especialmente em bezerros, a ingestão de alimentos contaminados com DON resulta em menor ganho de peso, letargia (Imagem 11) e maior susceptibilidade a doenças infecciosas (por exemplo, diarreia, Imagem 12) (Panisson et al., 2023; Hasuda et al., 2022; Ogunade et al., 2018; Nagl et al., 2014; Heliez et al., 2009; Pinton et al., 2009; Mallmann et al., 2007).

Imagem 11. Letargia.

Imagem 12. Diarreia.
Toxina T-2
A toxina T-2 é uma das micotoxinas mais tóxicas para os ruminantes. Foram documentados efeitos citotóxicos e imunotóxicos, assim como alterações na síntese de proteínas (incluindo RNA e DNA), na função reprodutiva e no metabolismo energético. Além disso, a toxina T-2 pode provocar tremores ou paralisia nas extremidades posteriores (Ogunade et al., 2018; Kemboi et al., 2020). Frequentemente, observam-se danos no trato gastrointestinal (Imagens 13-14), vasos sanguíneos e coração (Imagem 15), medula óssea, fígado, sistema nervoso e membranas mucosas (Imagens 16-17).
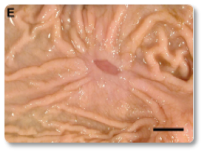
Imagem 13. Lesão crônica ulcerativa multifocal no abomaso
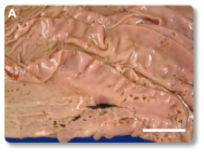
Imagem 14. Lesão aguda ulcerativa multifocal no abomaso
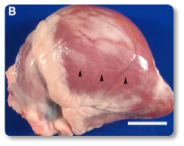
Imagem 13. Coração com áreas pálidas multifocais que se fundem, fibrose miocárdica no ventrículo direito e no ápice.
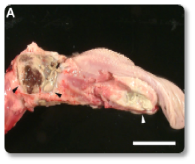
Imagem 16. Estomatite multifocal necrótica e purulenta, afetando a faringe e a língua.
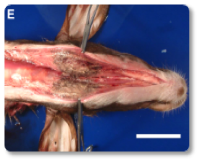
Imagem 17. Edema subcutâneo marcado no pescoço e na região submandibular, e necrose muscular.
Fumonisinas
A família das fumonisinas é composta por mais de 30 tipos diferentes, entre os quais os mais estudados atuam principalmente substituindo a esfingosina nas reações biológicas, o que provoca falhas na estrutura molecular (Fink-Gremmels, 2008). O dano primário parece ocorrer no trato gastrointestinal, nos rins e no fígado (Hartinger et al., 2022). Além disso, foi descrita a redução da ingestão de matéria seca e aumento da suscetibilidade a doenças (Fink-Gremmels, 2008). As fumonisinas podem ser degradadas no rúmen e são mal absorvidas pelos ruminantes, por isso os sintomas, como a diminuição da fermentação ruminal e alterações na microbiota, são mais evidentes com altos níveis de exposição ou coexposição com outras toxinas ou fatores de estresse (Gallo et al., 2020).
Ocratoxina A
A ocratoxina A (OTA) pode causar danos e insuficiência renal (Imagem 18), estresse oxidativo e danos hepáticos (Imagem 19), assim como imunossupressão. A OTA pode ter efeitos sinérgicos com a ZEA, exacerbando as alterações reprodutivas induzidas por ambas.

Imagem 18. Rins enegrecidos, friáveis e autolíticos.
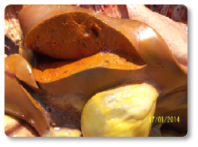
Imagem 19. Hepatite, fígado amarelado com vesícula biliar edemaciada, enfisema perivesicular.
Alcaloides de Ergotamina
Foram descritos surtos significativos de ergotismo em bovinos e equinos nos anos 90 após a administração de trigo e aveia infectados com Claviceps purpurea (Ilha et al., 2003; Riet-Correa et al., 1988, 2013). No caso dos bovinos, a intoxicação ocorreu pelo consumo de farelo de trigo, apresentando principalmente a síndrome distérico. Além disso, foram observados casos de ergotismo gangrenoso, com perda da ponta das orelhas e da ponta da cauda (Imagens 20-21), letargia (Imagem 22) e hiperexcitabilidade (Imagem 21), em bovinos alimentados com feno de milho contaminado com centeio infectado por C. purpurea (Riet-Correa et al., 2013). Também foram descritos tremores que inicialmente afetam o pescoço e a cabeça, e posteriormente se generalizam, além de congestão episcleral (Imagem 23) (Riet-Correa et al., 2013).

Imagem 20. Perda da ponta da cauda e hiperexcitabilidade

Imagem 21. Letargia e perda da ponta da cauda.
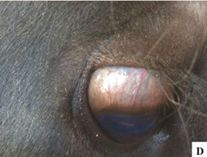
Image 22. Congestão episcleral.
Conclusão
Os sintomas clínicos das micotoxinas em ruminantes são variados e dependem tanto da natureza da toxina quanto da sua concentração e do tempo de exposição. Essas substâncias podem comprometer a saúde animal ao causar alterações metabólicas, imunossupressão, danos hepáticos, distúrbios reprodutivos e efeitos neurológicos. A detecção precoce e o manejo adequado das forragens contaminadas são essenciais para minimizar seu impacto e garantir o bem-estar dos animais e a produtividade do rebanho.



