Introducción
Las micotoxinas son metabolitos secundarios producidos por diversos hongos, y aunque todas pertenecen a esta categoría, sus estructuras moleculares presentan diferencias significativas que impactan en sus propiedades químicas. Comprender estas diferencias es crucial para abordar los diferentes mecanismos de adsorción.
Uno de los parámetros más relevantes que ha evaluado históricamente la capacidad de adsorción de estas sustancias es la polaridad química o sólo polaridad.
¿Qué es la polaridad química?
La polaridad química es una propiedad que describe la distribución desigual de las cargas eléctricas en una molécula. Esta característica se relaciona estrechamente con otras propiedades físicas y químicas, tales como la solubilidad, el punto de fusión, el punto de ebullición y las fuerzas intermoleculares.
Cuando se forma un enlace covalente entre átomos, el par de electrones que forma el enlace tiende a desplazarse hacia el átomo que posee mayor carga nuclear, es decir, aquel que tiene más protones. Este desplazamiento genera una distribución desigual de la carga, formando un dipolo eléctrico. Cuanto mayor sea la diferencia en electronegatividad entre los átomos involucrados en el enlace, más polar será este. Por el contrario, en enlaces formados por átomos iguales o con diferencias de electronegatividad muy reducidas, la atracción del par de electrones es equilibrada, resultando en moléculas apolares.
Por ejemplo, el agua es una molécula polar. Está formada por oxígeno y dos hidrógenos, con electronegatividades diferentes (Imagen 1). La diferencia de electronegatividad polariza cada enlace H – O, desplazando sus electrones hacia el oxígeno (ilustrado por flechas rojas). Estos efectos se suman como vectores para hacer que la molécula en general sea polar. Siendo la región del oxígeno indicado en rojo la parte más electronegativa.
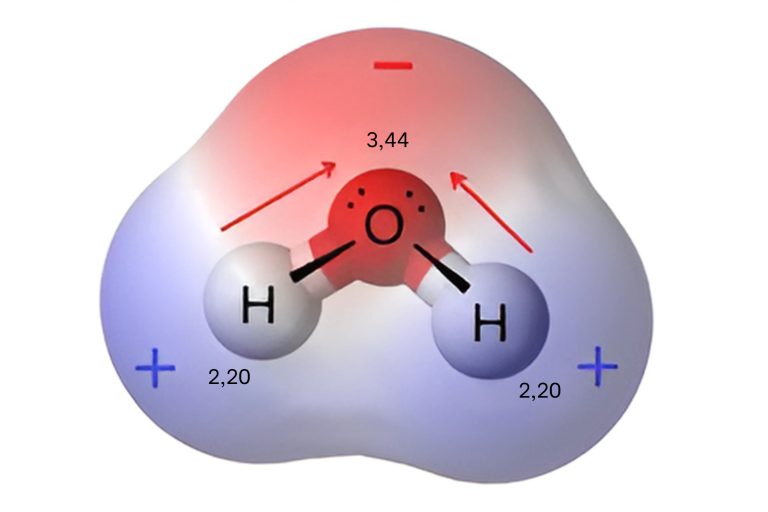
Imagen 1. Representación densidad electrónica molécula de agua (H2O).
¿Cómo determinar la polaridad de una molécula?
No todas las moléculas que contienen enlaces polares son polarizadas en su totalidad. De hecho, esto depende de la cantidad de enlaces polares presentes y de la disposición espacial de la molécula. Para determinar si una molécula es polar, se utiliza el concepto de momento dipolar eléctrico, que se define como la magnitud vectorial que resulta del producto de la carga (q) por la distancia (d) entre las cargas. La dirección de este vector va de la carga negativa a la positiva. La polaridad total de la molécula es, por lo tanto, la suma vectorial de los momentos dipolares de todos los enlaces presentes.
Mediante modelización molecular es posible modelar las estructuras de las micotoxinas y determinar las áreas donde existe una mayor polaridad. En las siguientes modelizaciones se representa distribución carga de las principales micotoxinas por orden de polaridad. La zona roja representa la con mayor electronegatividad, mientras que la azul se refiere a la zona con mayor electro positividad (ver siguientes imágenes).
Aflatoxina B1
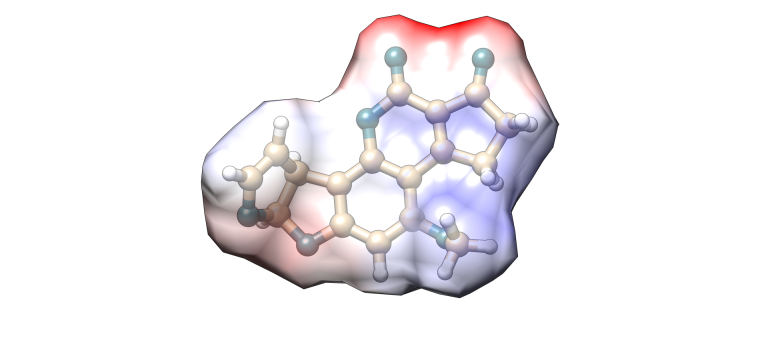
Imagen 2. Modelización molecular Aflatoxina B1.
Fumonisina B1
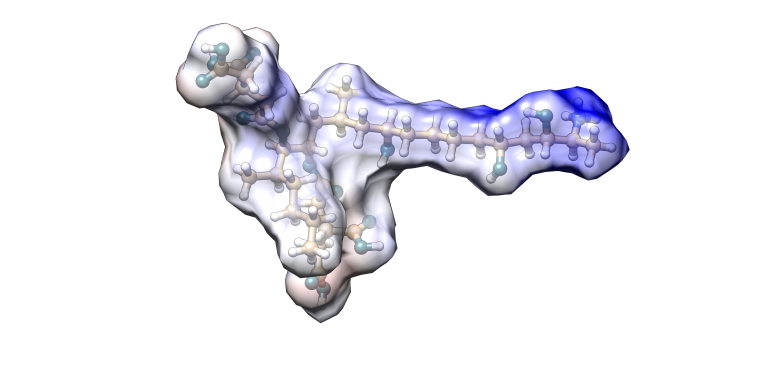
Imagen 3. Modelización molecular Fumonisina B1.
Ocratoxina A
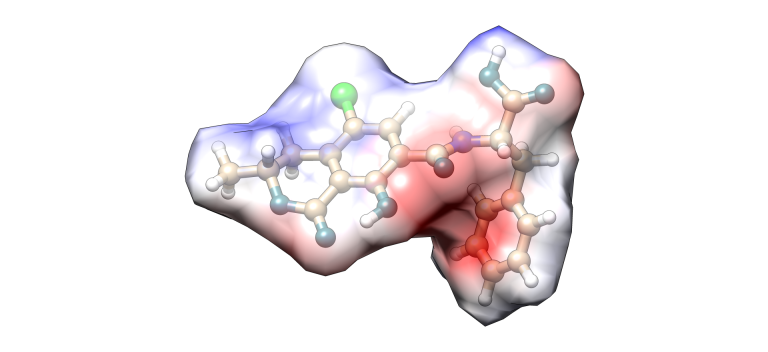
Imagen 4. Modelización molecular Ocratoxina
Tricótecenos
Toxina T-2
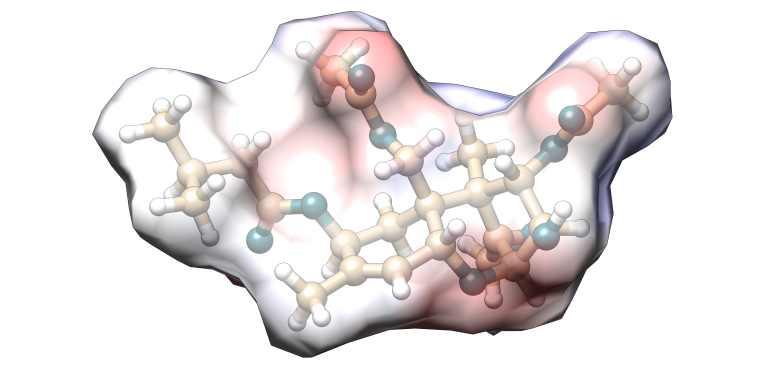
Imagen 5. Modelización molecular Toxina T-2
Deoxinivalenol
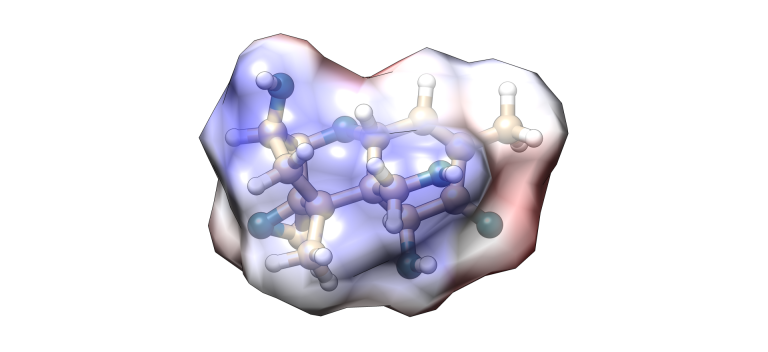
Imagen 6. Modelización molecular Deoxinivalenol.
Zearalenona
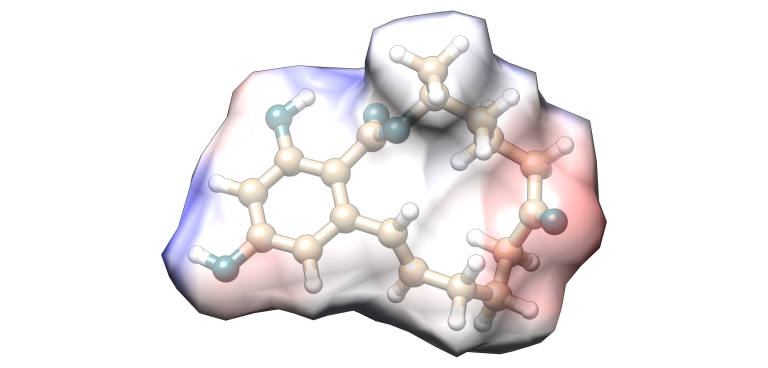
Imagen 7. Modelización molecular Zearalenona
Importancia de la polaridad en las micotoxinas
La polaridad es una característica fundamental en la química de las micotoxinas, ya que influye en su comportamiento en diversos entornos. Este parámetro no solo ayuda a identificar y clasificar diferentes micotoxinas, sino que también es crucial para diseñar estrategias efectivas de mitigación de sus efectos tóxicos. Por ejemplo, la polaridad puede determinar la eficacia de productos adsorbentes utilizados para prevenir la absorción de estas sustancias en el organismo.
Aunque no es posible explicar la eficacia de la adsorción únicamente con la polaridad de las micotoxinas, este parámetro es muy importante para explicar el comportamiento frente la adsorción.
Si nos focalizamos en el uso de bentonitas como adsorbentes de aflatoxinas, estas arcillas presentan minerales filosilicatos, que tienen una forma laminar con capas, las cuales, al hidratarse, se expanden generando un espacio laminar característico. En este espacio es donde la aflatoxina se puede introducir y ser retenida ya que por las interacciones electrostáticas la zona con mayor carga (color rojo) interacciona con las láminas
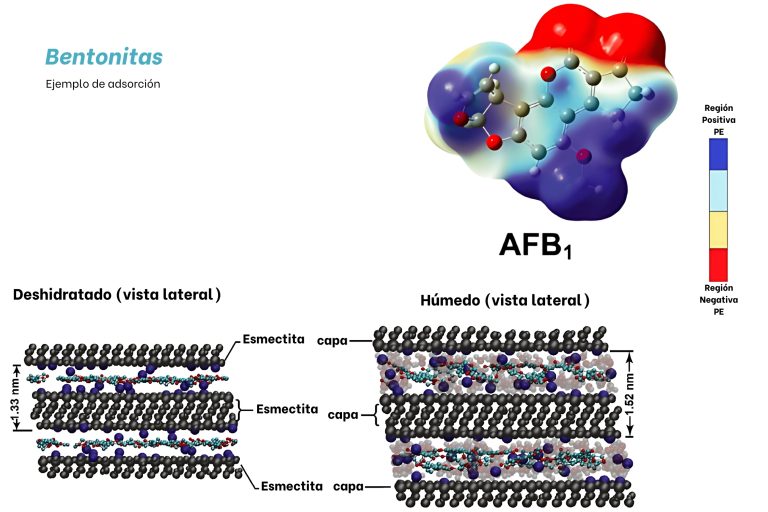
Imagen 8. Imagen representación la estructura laminar de los minerales filosilicatos presentes en las bentonitas. Martínez et al. (2023)
Entre los factores que influyen en la capacidad de adsorción de los diferentes materiales sobre las micotoxinas, se encuentra su estereoquímica. La forma y el tamaño de la micotoxina juegan un papel crítico en su capacidad de penetrar entre las láminas de la bentonita, lo que hace esencial elegir la bentonita adecuada para un proceso de adsorción específico. Para optimizar la eficiencia de adsorción, es crucial determinar la separación optima entre las láminas de bentonita. Si la distancia es demasiado pequeña, las moléculas no podrán ingresar en la estructura; por otro lado, si la separación implica una distancia elevada la adsorción no será específica y la fuerza de adsorción será menor. Otro punto importante es la capacidad de contacto entre micotoxinas y bentonitas. Esto se consigue evaluando las bentonitas las cuales se optimiza el tamaño de partícula y de esta forma se consigue una adsorción máxima. Todos estos puntos se evalúan experimentalmente mediante pruebas de adsorción in vitro.
Por ejemplo, la micotoxina polar que presenta mejor adsorción es la aflatoxina, ya que tiene una estructura plana que le permite introducirse entre las láminas de los minerales de las bentonitas. Además, su zona electronegativa la convierte en una molécula polar, lo que facilita su retención mediante interacciones electroestáticas.
Estos mecanismos de adsorción de micotoxinas además de ser realizados por las bentonitas, también pueden ser llevados a cabo por otros minerales filosilicatos, como las arcillas sepiolíticas. De hecho, unas de las estrategias utilizadas es la combinación de ambos tipos de arcillas, lo que puede aportar efectos sinérgicos en la adsorción frente a las diferentes micotoxinas de manera más eficiente y específica. Asimismo, durante la formulación también se tiene en cuenta otros parámetros para garantizar un almacenamiento adecuado y una óptima aplicabilidad del producto para que el producto no sea muy polvoriento o se formen agregados.
Conclusión
Entender la polaridad química de las micotoxinas es esencial para comprender los efectos de adsorción. A través de este conocimiento, se pueden desarrollar estrategias más efectivas para mitigar el riesgo que representan, garantizando así la seguridad de los alimentos y la salud de los animales. La investigación en este campo no solo nos proporciona información vital sobre las micotoxinas, sino que también subraya la importancia de la química en la comprensión de los fenómenos biológicos y ambientales.



