Introduction
Chez le porc, la phase de sevrage représente l’une des phases les plus délicates de leur cycle de production. En effet, durant cette période, les porcelets doivent relever une série de défis pour réussir à surmonter les changements dans leur physiologie digestive et dans leur système immunitaire.
Aujourd’hui, les processus de gestion dans les élevages porcins sont hautement spécialisés pour surmonter avec succès cette phase de production. Ce n’est pas un hasard si les régimes supplémentés sont très spécifiques à chaque phase de production et sont adaptés en fonction de leurs besoins nutritionnels.
Cependant, le succès de cette phase peut être compromis par des facteurs qui ne peuvent malheureusement pas être contrôlés et qui ne sont pas directement liés à la gestion agricole. L’un des exemples les plus fréquents est la contamination des matières premières et des aliments pour animaux par des mycotoxines.
La contamination des régimes alimentaires par des mycotoxines, comme l’aflatoxine B1 et les fumonisines, entraîne une diminution des paramètres de production et une altération du système immunitaire (Magnoli et al., 2019).
Par conséquent, l’une des solutions les plus efficaces pour réduire ses effets est l’inclusion de produits anti-mycotoxines dans l’alimentation des animaux. Il existe sur le marché de nombreux produits développés avec cet objectif, cependant, il est important de souligner que le mécanisme d’action n’est pas le même.
BIŌNTE® QUIMITŌX® PLUS: Essai in vivo chez des porcelets sevrés
Chez BIŌNTE nous avons développé BIŌNTE® QUIMITŌX® PLUS, une solution anti-mycotoxines composée de matériaux adsorbants, une combinaison unique d’extraits naturels et de levures sélectionnées, ce qui en fait une solution inimitable en nutrition animale.
Lors d’un précédent essai réalisé par l’Université de Thessalie (Grèce) sur des porcelets sevrés, les résultats ont montré comment BIŌNTE® QUIMITŌX® PLUS avaient contrecarré l’effet des mycotoxines et avait même amélioré les paramètres de production.
Compte tenu des résultats obtenus lors de la première phase, un deuxième essai a été réalisé, en collaboration avec l’Université de Thessalie (Grèce), pour tester l’efficacité de BIŌNTE® QUIMITŌX® PLUS sur les performances animales et le statut antioxydant chez des porcs sevrés exposés à l’aflatoxine B1 et aux fumonisines (FB1+FB2).
Conditions de la ferme
L’efficacité de BIŌNTE® QUIMITŌX® PLUS a été testée sur 150 porcelets, âgés de 28 jours, ayant reçu deux traitements :
Contrôle: alimentation naturellement contaminée par 3,9 ppb d’aflatoxine B1 (AFB1), 2309,1 de fumonisine B1 (FB1) et 663,9 ppb de fumonisine B2 (FB2) ;
Expérimental: alimentation naturellement contaminée complétée par 2,5 kg/t de BIŌNTE® QUIMITŌX® PLUS (Figure 1).
Le régime témoin présente une polycontamination par des mycotoxines, qui peuvent provoquer des effets négatifs synergiques et, par conséquent, réduire l’augmentation et augmenter la mortalité de cette espèce.
Tout au long du processus, la consommation alimentaire, le poids vif (LW), le gain de poids quotidien (ADG) et la mortalité sont surveillées quotidiennement. À titre d’exemple, nous collecterons des échantillons de plasma pour analyser la fonction antioxydante, y compris les substances réactives à l’acide thiobarbiturique (TBARS), les carbones protéiques (CARB) et la capacité antioxydante totale (TAC). À la fin dell essai, les résultats du tissu intestinal seront révélés pour évaluation histopathologique.

Figure 1. Conditions expérimentales
BIŌNTE® QUIMITŌX® PLUS: un véritable allié dans l'amélioration des paramètres de production
Comme le montre la Figure 2, BIŌNTE® QUIMITŌX® PLUS a amélioré les paramètres de production, avec une amélioration de 16,6% du poids vif (LW) et de 12,5% du gain de poids quotidien (ADG), après 42 jours de sevrage. De plus, la mortalité a été réduite de 60%, indiquant l’effet bénéfique de BIŌNTE® QUIMITŌX® PLUS dans l’optimisation de cette phase productive critique.
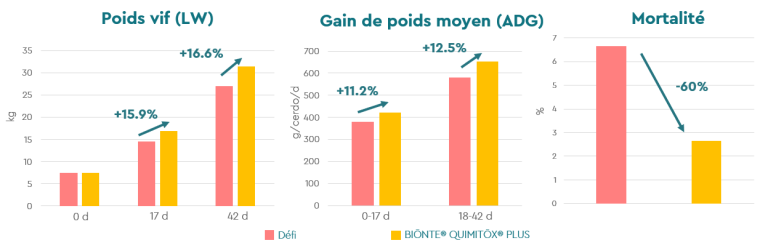
Figure 2. Paramètres de production chez les porcelets sevrés nourris avec ou sans BIŌNTE® QUIMITŌX® PLUS
Selon les résultats présentés dans la Figure 3, BIŌNTE® QUIMITŌX® PLUS a atténué le stress oxydatif, car il a réduit les biomarqueurs TBARS et CARB de 26,1% et 10,1%, respectivement, en plus d’augmenter la fonction antioxydante totale (TAC) de 3,8%.
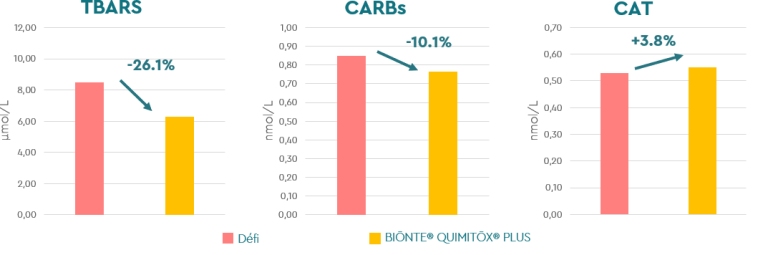
Figure 3. Biomarqueurs du stress oxydatif chez les porcelets sevrés nourris avec ou sans BIŌNTE® QUIMITŌX® PLUS
BIŌNTE® QUIMITŌX® PLUS réduit les lésions intestinales induites par AFB1 et FB1+FB2
L’un des organes les plus touchés chez les animaux qui consomment des aliments contaminés par des mycotoxines est l’intestin. Sur la Figure 4, la photo de gauche reflète les lésions constatées chez les porcelets n’ayant reçu aucun produit anti-mycotoxine dans leur alimentation : légère infiltration de là lamina propria par les lymphocytes et les plasmocytes, ainsi que nécrose de l’épithélium. Cependant, les porcelets recevant BIŌNTE® QUIMITŌX® PLUS, photo de droite, ont montré une absence de nécrose de l’épithélium intestinal, ce qui confirme une fois de plus la capacité du produit à atténuer les effets nocifs sur les animaux.
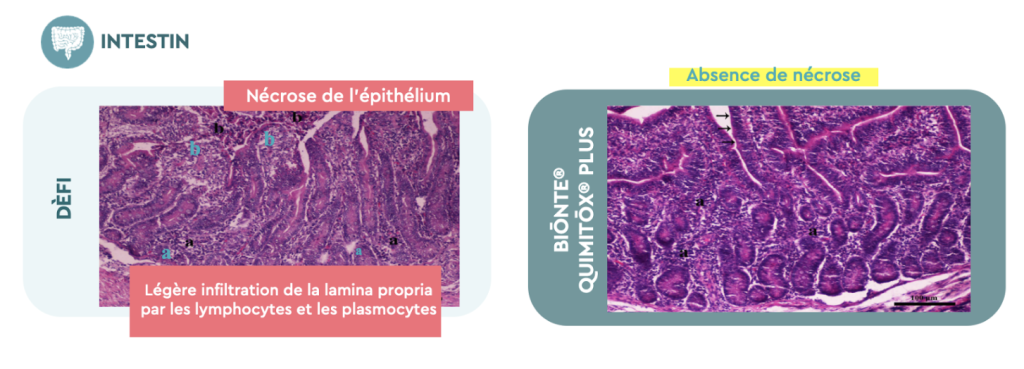
Figure 4. Examen histopathologique de l’intestin chez des porcelets sevrés nourris avec ou sans BIŌNTE® QUIMITŌX® PLUS
Conclusion
Cette étude confirme la capacité de BIŌNTE® QUIMITŌX® PLUS à atténuer les effets des mycotoxines, en plus d’améliorer les paramètres de production et de soulager le stress oxydatif chez les porcelets sevrés.



