Introducción
Los rumiantes son considerados menos susceptibles al efecto de las micotoxinas en comparación con el resto de especies. Los procesos de biotransformación que suceden en la microbiota ruminal convierten algunas de estas sustancias en compuestos menos tóxicos para estos animales (Xu et al., 2023). Sin embargo, se ha demostrado que las micotoxinas siguen resultando perjudiciales para la producción de este tipo de ganado, y que la alteración del entorno ruminal puede dificultar la detoxificación (Álvarez-Días et al., 2022).
Algunas micotoxicosis causan enfermedades, agudas o crónicas, con signos clínicos y patologías evidentes. Pero hay que tener en cuenta que pueden causar enfermedades subclínicas o descensos de la productividad, así como efectos carcinogénicos, mutagénicos, teratogénicos, inmunosupresores y endocrinos, difíciles de diagnosticar.
Estas enfermedades pueden influir negativamente en el rendimiento y la productividad de los rumiantes, dando lugar a problemas a nivel reproductivo y desencadenando estados de inmunosupresión (Álvarez-Días et al., 2022). Se ha establecido una correlación evidente entre la presencia de micotoxinas en el alimento del ganado lechero y el rechazo al alimento, descenso en la producción de leche, diarreas e infertilidad (Ismail et al., 2020). La descendencia de los animales expuestos a micotoxinas, también se ve afectada. En el ganado bovino expuesto a aflatoxinas se ha detectado una descendencia más susceptible a sufrir procesos inflamatorios e infecciones secundarias. Además, este tipo de micotoxinas generan daños a nivel hepático y renal (Álvarez-Días et al., 2022).
Aflatoxinas
Las aflatoxinas representan un riesgo elevado en rumiantes, especialmente en vacas lecheras, debido a su demostrada transferencia a la leche que se destina a consumo humano o a la alimentación de terneros (Hernandez-Valdivia et al., 2021). La aflatoxina B1 (AFB1) es la más conocida dentro de esta familia, entre los efectos inducidos tras la exposición aguda o crónica destacan: la fibrosis hepática (cirrosis) con proliferación de células de los conductos biliares, megalocitosis, así como el estasis biliar e hígado hemorrágico (Imagen 1). Además, otros estudios han documentado cómo la exposición a esta micotoxina puede dar lugar a un hígado con textura bronceada pálida (Imagen 2); hígado y corazón congestivos (Imagen 3) y riñones hemorrágicos (Imagen 4) (Sajid Umar et al., 2015; Ismail et al., 2020; Álvarez-Días et al., 2022).
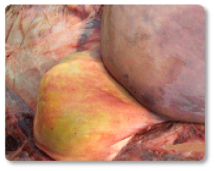
Imagen 1. Estasis biliar e hígado hemorrágico.
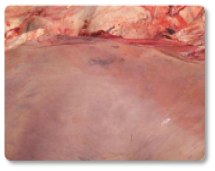
Imagen 2. Hígado con textura bronceada pálida.
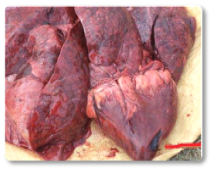
Imagen 3. Hígado y corazón congestivos.
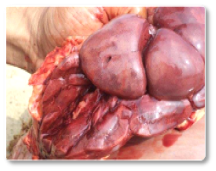
Imagen 4. Riñones hemorrágicos.
Además, la AFB1 causa inmunosupresión, lo que aumenta la susceptibilidad a infecciones secundarias y puede afectar a la productividad (Riet-Correa et al., 2013). Los síntomas clínicos descritos incluyen: inapetencia, depresión, diarrea (Imagen 5) y epistaxis (Imagen 6) (Sajid Umar et al., 2015; Ismail et al., 2020; Álvarez-Días et al., 2022).

Imagen 5. Diarrea.
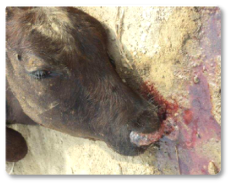
Imagen 6. Epistaxis.
Otros autores, también han descrito abortos y un aumento de la mortalidad (Imagen 7), así como prolapsos (Imagen 8) (McKenzie et al., 1981; Van Halderen et al., 1988; Felipe Penagos-Tabares et al., 2024).

Imagen 7. Imágenes de abortos a los 100 días (A), 215 días (B) y 260 días (C) de gestación.
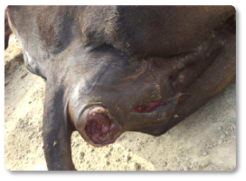
Imagen 8. Prolapso por aflatoxicosis.
Zearalenona
Al igual que en el resto de especies, en rumiantes, la zearalenona (ZEA) fundamentalmente induce alteraciones reproductivas. Su efecto estrogénico puede generar problemas de fertilidad, inflamación en la vulva y alteraciones en el ciclo reproductivo (Hartinger et al., 2022). La producción de leche también se ve afectada por esta micotoxina, observándose un descenso en la cantidad de litros producidos, así como una alteración de su calidad (Ogunade et al., 2018). Esta micotoxina puede desencadenar importantes problemas también en machos. Algunos autores han descrito casos de esterilidad ocasionados por su efecto oxidativo (Liu et al., 2023). La zearalenona causa también daños a nivel hepático y renal, así como edemas pulmonares (Hartinger et al., 2022). Asimismo, se ha descrito prolapso rectal (Imagen 9), agrandamiento de la vulva y prolapso uterino en vacas no gestantes (Imagen 10).

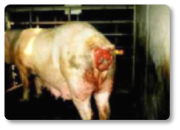
Imagen 9. Prolapso rectal.
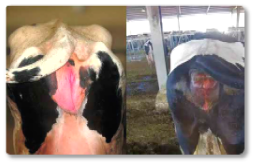
Imagen 10. Agrandamiento de la vulva y prolapso uterino en vacas no gestantes.
Deoxinivalenol
Los rumiantes que no padecen ninguna alteración metabólica o proceso inflamatorio son capaces de inactivar cantidades significativas de deoxinivalenol (DON). Sin embargo, la microbiota ruminal se puede ver afectada en casos de fermentación alterada, defaunación o bajo pH ruminal (Whitlow y Hagler, 2007). En situaciones de alta contaminación de los piensos, exposición prolongada o defensas comprometidas, el DON puede reducir la ingestión de materia seca, comprometer la reproducción y alterar el sistema inmunitario (Guerrero-Netro et al., 2021). Especialmente en terneros, la ingestión de alimentos contaminados con DON supone una menor ganancia de peso, letargia (Imagen 11) y una mayor susceptibilidad a enfermedades infecciosas (e.g. diarrea, Imagen 12) (Panisson et al., 2023; Hasuda et al., 2022; Ogunade et al., 2018; Nagl et al., 2014; Heliez et al., 2009; Pinton et al., 2009; Mallmann et al., 2007).

Imagen 11. Letargia.

Imagen 12. Ternero con diarrea.
Toxina T-2
La toxina T-2 es una de las micotoxinas más tóxicas para los rumiantes. Se han documentado efectos citotóxicos e inmunotóxicos, así como alteraciones en la síntesis de proteínas (incluyendo ARN y ADN), en la función reproductiva y en el metabolismo energético. Además, la toxina T-2 puede provocar temblores o parálisis en las extremidades posteriores (Ogunade et al., 2018; Kemboi et al., 2020). A menudo se observan daños en el tracto gastrointestinal (Imágenes 13-14), vasos sanguíneos y corazón (Imagen 15), médula ósea, hígado, sistema nervioso y membranas mucosas (Imágenes 16-17).
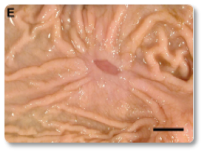
Imagen 13. Abomasitis crónica ulcerativa multifocal.
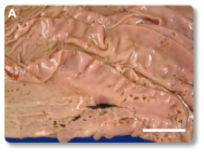
Imagen 14. Abomasitis aguda ulcerativa multifocal.
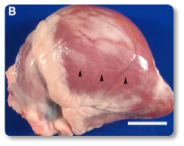
Imagen 15. Corazón con áreas pálidas multifocales que se fusionan, fibrosis miocárdica en el ventrículo derecho y el ápice.
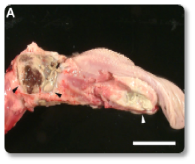
Imagen 16. Estomatitis multifocal necrotizante y purulenta, afectando a faringe y lengua.
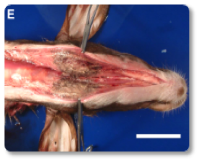
Imagen 17. Macado edema subcutáneo en el cuello y la región submandibular, y necrosis muscular.
Fumonisinas
La familia de las fumonisinas está conformada por más de 30 tipos diferentes, entre las cuales las más estudiadas actúan principalmente sustituyendo a la esfingosina en las reacciones biológicas, lo que provoca fallos en la estructura molecular (Fink-Gremmels, 2008). El daño primario parece producirse en el tracto gastrointestinal, riñón e hígado (Hartinger et al., 2022). Asimismo, se ha descrito reducción de la ingestión de materia seca y aumento de la susceptibilidad a las enfermedades (Fink-Gremmels, 2008). Las fumonisinas pueden degradarse en el rumen y son mal absorbidas por los rumiantes, por lo que los síntomas, tales como disminución de la fermentación ruminal y alteración del microbiota, son más evidentes con altos niveles de exposición o co-exposición con otras toxinas o factores de estrés (Gallo et al., 2020).
Ocratoxina A
La ocratoxina A (OTA) puede causar daños e insuficiencia renal (Imagen 18), estrés oxidativo y daño hepático (Imagen 19), así como inmunosupresión. La OTA puede tener efectos sinérgicos con la ZEA, exacerbando las alteraciones reproductivas inducidas por las mismas.

Imagen 18. Riñones negros, friables y autolíticos
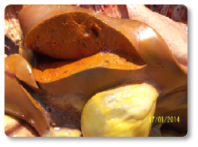
Imagen 19. Hepatitis, hígado ocre con vesícula biliar accidentada, enfisema perivesicular.
Alcaloides de ergóticos
Se han descrito brotes significativos de ergotismo en bovinos y equinos en los años 90 tras la suministración de trigo y avena infectados con Claviceps purpurea (Ilha et al., 2003; Riet-Correa et al., 1988, 2013). En el caso de los bovinos, la intoxicación ocurrió por el consumo de salvado de trigo, presentándose principalmente el síndrome distérmico. Además, se han observado casos de ergotismo gangrenoso, con pérdida de la punta de las orejas y de la punta de la cola (Imágenes 20-21), letargia (Imagen 22) e hiperexcitabilidad (Imagen 21), en bovinos alimentados con heno de maíz contaminado con centeno infectado por C. purpurea (Riet-Correa et al., 2013). Asimismo, se han descrito temblores que inicialmente afectan al cuello y la cabeza y posteriormente se generalizan, y congestión episcleral (Imagen 23) (Riet-Correa et al., 2013).

Imagen 20. Pérdida de las puntas de las orejas.

Imagen 21. Pérdida de la punta de la cola e hiperexcitabilidad.

Imagen 22. Letargia y pérdida de la punta de la cola.
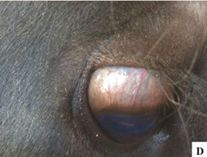
Imagen 23. Congestión episcleral.
Conclusión
Los síntomas clínicos de las micotoxinas en rumiantes son variados y dependen tanto de la naturaleza de la toxina, como de su concentración y del tiempo de exposición. Estas sustancias pueden comprometer la salud animal al provocar alteraciones metabólicas, inmunosupresión, daño hepático, trastornos reproductivos y efectos neurológicos. La detección temprana y el manejo adecuado de los forrajes contaminados son esenciales para minimizar su impacto y garantizar el bienestar de los animales y la productividad ganadera.



