Definición, etimología y principios generales
Las micotoxinas fueron descubiertas hace más de 5000 años en China, y en el año 1962 se conocieron por primera vez sus efectos, a raíz de una devastadora crisis veterinaria que surgió cerca de Londres (Inglaterra), en la que murieron aproximadamente 100.000 pavos (Blount, 1961). Sucesivamente, cuando esta misteriosa enfermedad se relacionó con una harina de cacahuete contaminada con metabolitos secundarios procedentes de Aspergillus flavus (aflatoxinas), los científicos de aquella época especularon la posibilidad de que otros metabolitos del moho pudieran ser mortales. Pronto, la clasificación de las micotoxinas se extendió para incluir una serie de compuestos producidos por hongos previamente conocidos (como, por ejemplo, los alcaloides del cornezuelo del centeno), algunos compuestos aislados originalmente como antibióticos (e. g. patulina) y una serie de nuevos metabolitos secundarios tras analizar los presuntos mohos perjudiciales para la salud humana y los animales (por ejemplo, la ocratoxina A; Bennet et al., 2003).
Es difícil definir las micotoxinas en pocas palabras. Todas las micotoxinas son productos naturales de bajo peso molecular (es decir, moléculas pequeñas) producidos como metabolitos secundarios por hongos filamentosos. Estos metabolitos constituyen un conjunto toxigénico y químicamente heterogéneo, que puede causar enfermedad y muerte en seres humanos y otros vertebrados (Pitt et al., 2016).
La clasificación de las micotoxinas, así como su definición, es extremadamente peliaguda debido a la complejidad de su estructura química, su origen biosintético, sus múltiples efectos biológicos y su producción por un gran número de especies de hongos.
No obstante, a día de hoy se han identificado más de 400 micotoxinas, de las cuales alrededor de una docena de grupos reciben regularmente atención como riesgo para la salud humana y animal (Agriopoulou et al., 2020). Aunque no se hayan revelado las razones por las que se producen, se cree que sea un mecanismo de defensa contra los insectos, ya que muchas micotoxinas y sus metabolitos tienen propiedades insecticidas (Richard, 2015).
Los cultivos son especialmente susceptibles a la contaminación por hongos productores de micotoxinas, y esta contaminación puede ocurrir durante la cosecha (Diener et al., 1987), el almacenamiento o el transporte (Smith et al., 1985). Consecutivamente, cuando los animales se alimentan de estos productos contaminados, pueden ingerir las micotoxinas y estas producirles efectos tóxicos. Las intoxicaciones producidas por las micotoxinas se conocen como micotoxicosis. Para demostrar que una enfermedad es una micotoxicosis, es necesario demostrar una relación dosis-respuesta entre la micotoxina y la enfermedad y los síntomas.
Los síntomas de una micotoxicosis dependen del tipo de micotoxina; la cantidad y duración de la exposición; la edad, el estado de salud y el sexo del individuo expuesto.
Las micotoxinas juegan un papel fundamental en el rendimiento, salud y bienestar animal; lo que ha llevado a una amplia investigación sobre este aspecto, que incluye información sobre la biosíntesis de micotoxinas, especies productoras y manifestaciones clínicas de cada una de ellas.
Caracterización y descubrimiento de las micotoxinas comunes
Este grupo de toxinas fue descubierto en los años 60’ por el veterinario William Percy Blount (Figura 1), tras la muerte de 100.000 pavos en Inglaterra. Después de una rigurosa serie de pruebas, que abarcaron desde el análisis de las principales toxinas bacterianas hasta una amplia gama de productos químicos, pesticidas e ingredientes de piensos, Blount (1961) identificó que la causa subyacente de estas trágicas muertes estaba directamente relacionada con la alimentación de las aves.
Aunque se confirmó la conexión entre la intoxicación y la dieta, la causa precisa aún permanecía sin definir.

Figura 1. William Percy Blount.
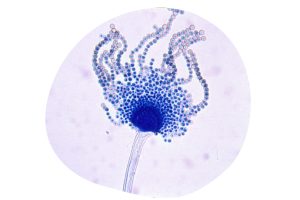
Figura 2. Aspergillus flavus.
Al mismo tiempo, en Kenia, se observó un aumento alarmante en los casos de enfermedades hepáticas entre los pollos, lo que condujo al descubrimiento de una harina de cacahuete contaminada por Aspergillus flavus (Figura 2), del que también procede su nombre.
Este hallazgo fue realizado por el investigador J. J. Elphick del Commonwealth Mycological Institute del Reino Unido, quien identificó este hongo gracias a la marcada fluorescencia de las AFs (Sargeant et al., 1961). Inicialmente, las técnicas utilizadas para poder estudiar este hongo, incluían la cromatografía en papel y más tarde, también se empleó cromatografía en capa fina (Comes et al., 1963; Broadbent et al., 1963).
El avance decisivo en la identificación del origen de las AFs fue posible por la proximidad geográfica de los pavos afectados al puerto de Londres. Esta proximidad permitió rastrear las fuentes de alimentación, lo que condujo a la identificación de las posibles materias primas contaminadas, en particular de la harina S.S. Rossetti, que llegó de Brasil el 7 de julio de 1960. En los años siguientes se produjeron avances significativos, como el desarrollo de métodos analíticos más fiables y la identificación de cuatro AFs (B1, B2, G1 y G2) a partir de sus colores fluorescentes en la cromatografía en capa fina (Nesbitt et al., 1962; Pitt et al., 2016).
En el 1920, el maíz contaminado por mohos se asoció ocasionalmente con síntomas estrogénicos en cerdos en Estados Unidos (McNutt et al., 1928). El mismo alimento fue suministrado tanto a conejillos de indias como a ratas, resultando en el desarrollo de hinchazón del útero en ambas especies.
Christensen et al. (1965) lograron aislar los compuestos presentes en el maíz mohoso, así identificando dos estructuras: F-1 y F-2.
La identificación de la F-1 se denominó ergosterol y pudo ser confirmada mediante diversas reacciones químicas.
Por otro lado, Urry et al. (1966) determinaron la estructura química de la F-2, posteriormente denominada ZEA debido a su estructura y al hongo que la produce (Fusarium graminearum; Figura 3).
Una forma sintética del metabolito α-ZAL, conocida como zeranol se utilizó como agente anabólico tanto en ovejas, cerdas y otras especies de Estados Unidos (Diekman et al., 1989). Sin embargo, en el 1989, la Unión Europea (UE) prohibió el uso de zeranol.
Las cerdas presentan una elevada sensibilidad a esta micotoxina, sobre todo por los efectos que han sido reportados en la literatura y que afectan principalmente al sistema reproductivo (Figura 4).
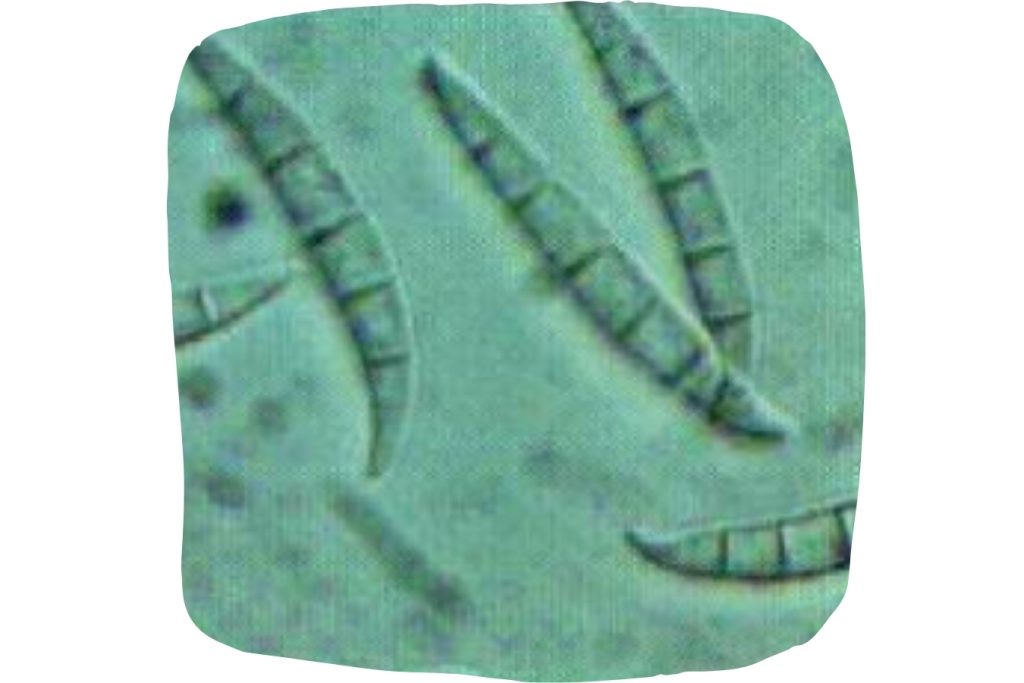
Figura 3. Fusarium graminearum.
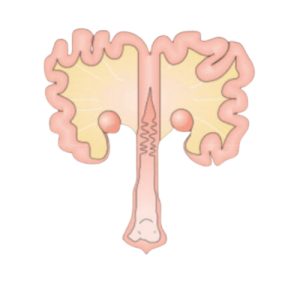
Figura 4. Sistema reproductivo de las cerdas.
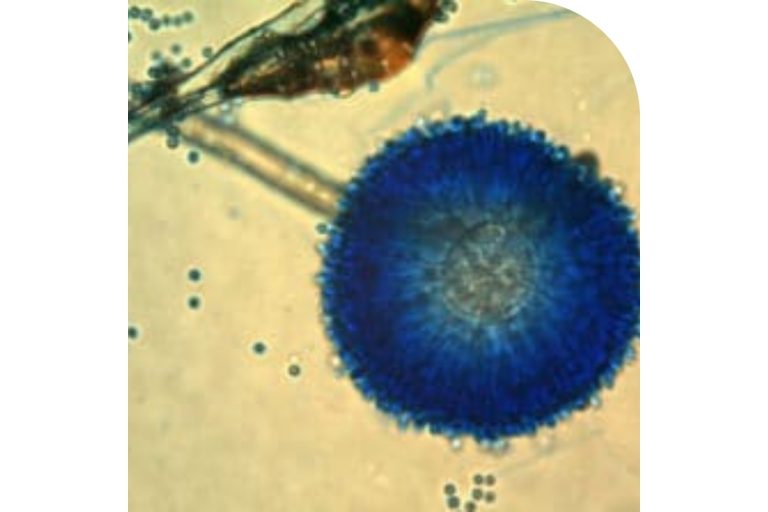
Figura 5. Aspergillus ochraceus.
La OTA fue aislada y caracterizada el año 1965, en Sud África, como metabolito del hongo Aspergillus ochraceus (Figura 5), durante un gran cribado de metabolitos fúngicos diseñado específicamente para identificar nuevas micotoxinas (Van der Merwe et al., 1965).
Esta micotoxina tiene efectos sobre todo a nivel renal, lo que se ha descrito en todas las especies de producción animal (Figura 6).
Además, también se han descrito efectos a nivel hepático, a nivel inmunitario y tienen un potente efecto inmunosupresor, teratógeno y carcinógeno (Bennett et al., 2003).

Figura 7. Maíz contaminado con Fusarium graminearum.
El DON fue descubierto en el 1970 en Japón (Yoshizawa et al., 1973), como metabolito de Fusarium graminearum (Figura 7). Sucesivamente, Vesonder et al. (1973) publicaron datos acerca de un ensayo llevado a cabo en cerdos y, debido a los brotes de síndromes eméticos ocasionados por la presencia de DON en los piensos, esta micotoxina se conoce vulgarmente como “vomitoxina, de vómitos”.
Cuando es ingerido en altas dosis por los animales de granja, provoca náuseas, vómitos y diarrea; en dosis más bajas, los cerdos y otros animales de granja muestran pérdida de peso y rechazo a la comida (Rotter et al., 1996).
Por su parte, investigadores canadienses lograron elucidar el potencial toxigénico de F. graminearum, así como la existencia de dos quimiotipos importantes: 1) implicado en la producción de DON a través de 15-acetildeoxinivalenol; y 2) mediante del 3-acetildeoxinivalenol (Greenhalgh, et al., 1984; Kasitu, et al., 1992).
La T-2, producida por Fusarium sporotrichoides (Figura 8), fue aislada por primera vez en 1930 en muchas ciudades de la antigua Unión Soviética y es conocida por inducir la «Aleukia Tóxica Alimentaria» (ATA).
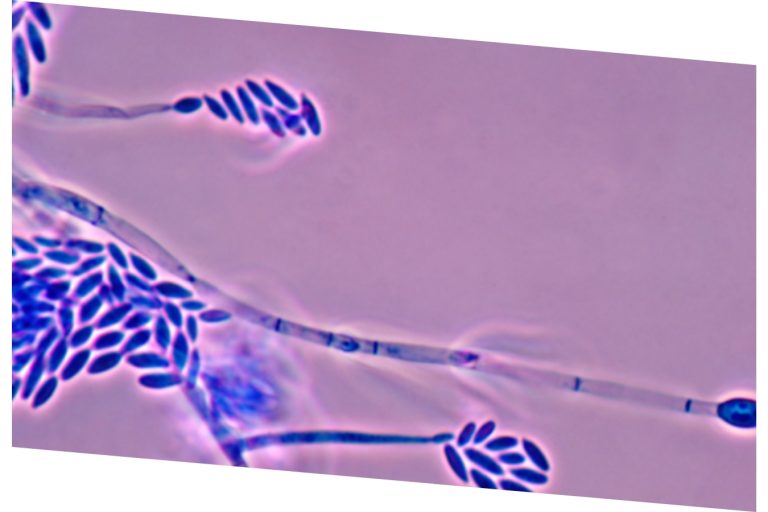
Figura 8. Fusarium sporotrichoides.
Durante la Segunda Guerra Mundial, debido a la escasez de mano de obra para cultivar el campo, las especies forrajeras se dejaban en el campo, lo que ayudaba a aumentar la exposición a de alimentos preparados con trigo contaminado. Sucesivamente, los científicos rusos identificaron los metabolitos conocidos como poaefusarina de Fusarium poae y esporofusarina de Fusarium sporotrichiodes (Joffe et al., 1971). Asimismo, investigadores de la Universidad de Wisconsin lograron aislar la T-2 en el 1966 que fue sucesivamente asociada con el desarrollo de la ATA (Mirocha et al., 1973).
Las FBs fueron descubiertas de manera independiente por dos grupos de trabajo en 1988. Uno de ellos investigaba la causa del cáncer de esófago en humanos en ciertas partes de Sudáfrica (Bezuidenhout et al., 1988), mientras que el otro se dedicaba a encontrar la etiología de una enfermedad bien conocida que afecta a los caballos, la ELEM (leucoencefalomalacia; Laurent et al., 1990). Este grupo de toxinas vienen producidas por las especies de Fusarium spp. Las más conocidas son las FB1 y FB2 y pueden afectar a los animales de diferentes maneras al interferir con el metabolismo de los esfingolípidos (Figura 9).

Figura 9. Estructura de los esfingolípidos.
Elevadas concentraciones de FB1 y FB2 pueden inducir “edema pulmonar en porcinos» (EPP) (Colvin et al., 1992; Prelusky et al., 1994). En exposiciones a bajas concentraciones de estas toxinas, se han reportado en lechones daños a nivel hepático y renal (Riley et al., 1993). En el caso de los pollos, se ha descrito que la sinergia de las fumonisinas junto con otras micotoxinas puede inducir el «síndrome mortal de contaminación» (Javed et al., 1993).
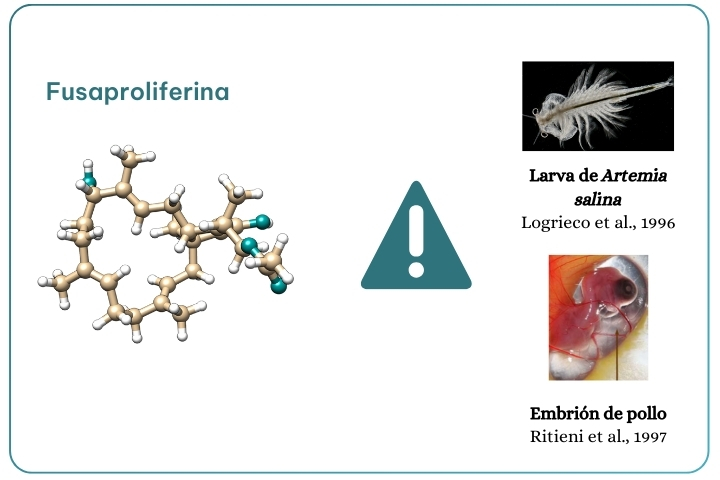
Figura 10. Toxicidad de la Fusaproliferina.
Uno de los primeros trabajos en utilizar este término “micotoxinas emegentes” se publicó en 2008 y se centra en los metabolitos de Fusarium fusaproliferina (Jestoi et al., 2008). En un documento más reciente, las micotoxinas emergentes se definieron como «micotoxinas, que no se determinan de forma rutinaria, ni están reguladas legislativamente; sin embargo, la evidencia de su incidencia está aumentando rápidamente» (Vaclavikova et al., 2013). Este grupo de micotoxinas, incluye fusaproliferina, beauvericina, enniatinas y moniliformina, todas producidas por la familia de Fusarium spp.
La fusaproliferina (Figura 10), producida por F. subglutinans, y F. verticillioides, fue aislada en 1995 por el investigador Ritieni. Los datos de toxicidad de los que disponemos se limitan a las larvas de Artemia salina y embriones de pollos, e incluyen efectos teratógenos (Logrieco et al., 1996; Ritieni et al., 1997).
Por su parte, la beauvericina (BEA; figura 11), se aisló por primera vez en 1991 en Estados Unidos (Gupta et al. 1991). Se han descrito propiedades insecticidas, antimicrobianas y antibióticas.
Aunque estudios in vitro han demostrado que la BEA es tóxica para los roedores y las aves de corral, estos resultados no se han confirmado in vivo (Jestoi et al., 2008; Dornetshuber et al., 2009).
Respecto a las enniatinas (ENNs) estas fueron descritas por Gaumann y su grupo de investigación en el 1947 a partir del hongo Fusarium orthoceras.
En estudios posteriores se descubrió una mezcla de enniatinas A (Figura 12), A1, B y B1 (Shemyakin et al., 1969) y se identificó un complejo rico en enniatina A y A1 como componente activo en una fracción insecticida dirigida a las larvas del gusano de la picea (Strongman et al., 1988). Las enniatinas (ENNs) poseen características antibacterianas, citotóxicas y oxidativas, alterando el equilibrio microbiano en el epitelio intestinal, lo que potencialmente conduce a efectos secundarios sobre la salud (Dornetshuber et al. 2009).
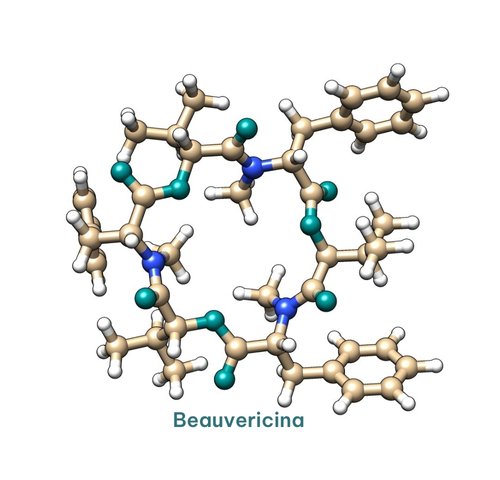
Figura 11. Estructura de la beauvericina.
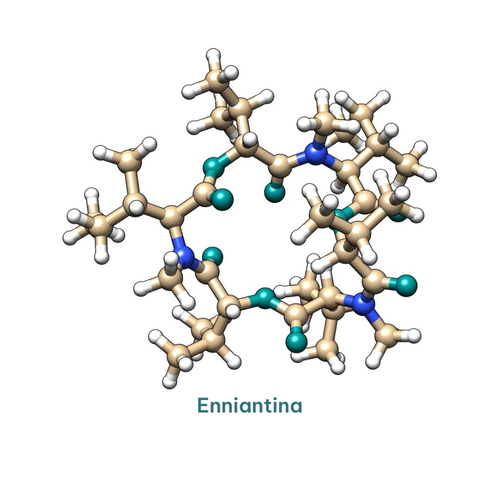
Figura 12. Estructura de la enniantina.
En este grupo de micotoxinas se incluyen los derivados de las micotoxinas que no son detectables mediante técnicas analíticas convencionales, puesto que su estructura ha cambiado.
Por ejemplo, en estudios destinados para evaluar la acumulación del DON en el maíz, Miller et al. (1983) observaron que la concentración de DON en el maíz de campo inoculado con F. graminearum disminuía durante la temporada de crecimiento. Los autores especularon que esta disminución podría deberse a una transformación química de la toxina por las enzimas de la planta. Poco después, se informó de que el contenido de DON de los productos alimenticios fermentados con levadura era superior al de la harina de trigo contaminada utilizada para su producción (Young et al., 1984). Este aumento se atribuyó a la conversión enzimática de un conjugado de DON, generado por la metabolización de la toxina por el trigo (Figura 13).

Figura 13. Biotransformación del DON
Por otro lado, la ZEApuede ser modificada por microorganismos y plantas, y estos compuestos modificadas pueden ser completamente convertidos en ZEA por la microbiota intestinal animal o humana. En humanos y animales, el metabolismo de ZEA puede dividirse en dos fases, que incluyen el metabolismo de fase I y el metabolismo de fase II (Zeng et al., 2019). El ZEA-14-sulfato, es uno de los compuestos encontrados en cultivos de Fusarium graminearum en 1991, (Gareis et al., 1990) y resulta del metabolismo de ZEA (Figura 14).
Figura 14. Estructura ZEA-14-sulfato.
Conclusiones
Aunque los efectos inducidos por micotoxinas han sido estudiados durante muchos años, a día de hoy, se sigue investigando sobre su mecanismo de acción y sobre las estrategias necesarias para paliar sus efectos en la salud humana y animal, las pérdidas agrícolas y los efectos potenciales del cambio climático.




