Uno de los aspectos fundamentales de la exposición a las micotoxinas es su toxicocinética. El término toxicocinética se refiere a la relación entre la concentración de una sustancia (en este caso la toxina) al que está expuesto un individuo y la concentración de compuestos toxicológicamente activos en el punto de acción (por ejemplo, órganos diana como hígado o riñón) donde las toxinas ejercen el efecto (Johanson et al., 2010).
El término absorción se refiere a la evaluación de la exposición en el lugar de acción y, más precisamente, de la velocidad de absorción (t Max) de la sustancia química desde el lugar de aplicación hasta el torrente sanguíneo (biodisponibilidad, F). El término distribución indica la velocidad y la intensidad del transporte de sustancias químicas de la sangre a los tejidos. El volumen aparente de distribución (Vd) indica el volumen en que se distribuye la cantidad de la toxina que alcanza la misma concentración que en la sangre. Otro de los procesos fundamentales de la toxicocinética es el del metabolismo que proporciona información acerca de la velocidad y el grado de la biotransformación química en metabolitos hidrosolubles e inactivos. Por último, el término excreción indica la eliminación de la toxina del organismo. Durante el proceso de excreción los parámetros de clearance (Cl: suma de todos los procesos que participan en la eliminación de la toxina y sus metabolitos) y la vida media de eliminación (t½: tiempo en que la concentración plasmática de un fármaco se reduce a la mitad) proporcionan información acerca del andamiento del proceso.
Como especificado por EFSA, el acrónimo ADME indica los cuatro procesos clave que describen cómo las toxinas entran en el organismo, su metabolismo y eliminación «absorción, distribución, metabolismo y excreción». Estos procesos nos permiten comprender las alteraciones que se producen a nivel bioquímico, aplicar pruebas diagnósticas, proponer un tratamiento adecuado en casos de intoxicación y estudiar el desarrollo y uso de productos. Los procesos ADME son una herramienta necesaria para evaluar la eficacia de los productos desarrollados para mitigar el efecto de las micotoxinas.
Aflatoxinas (AFs)
Absorción
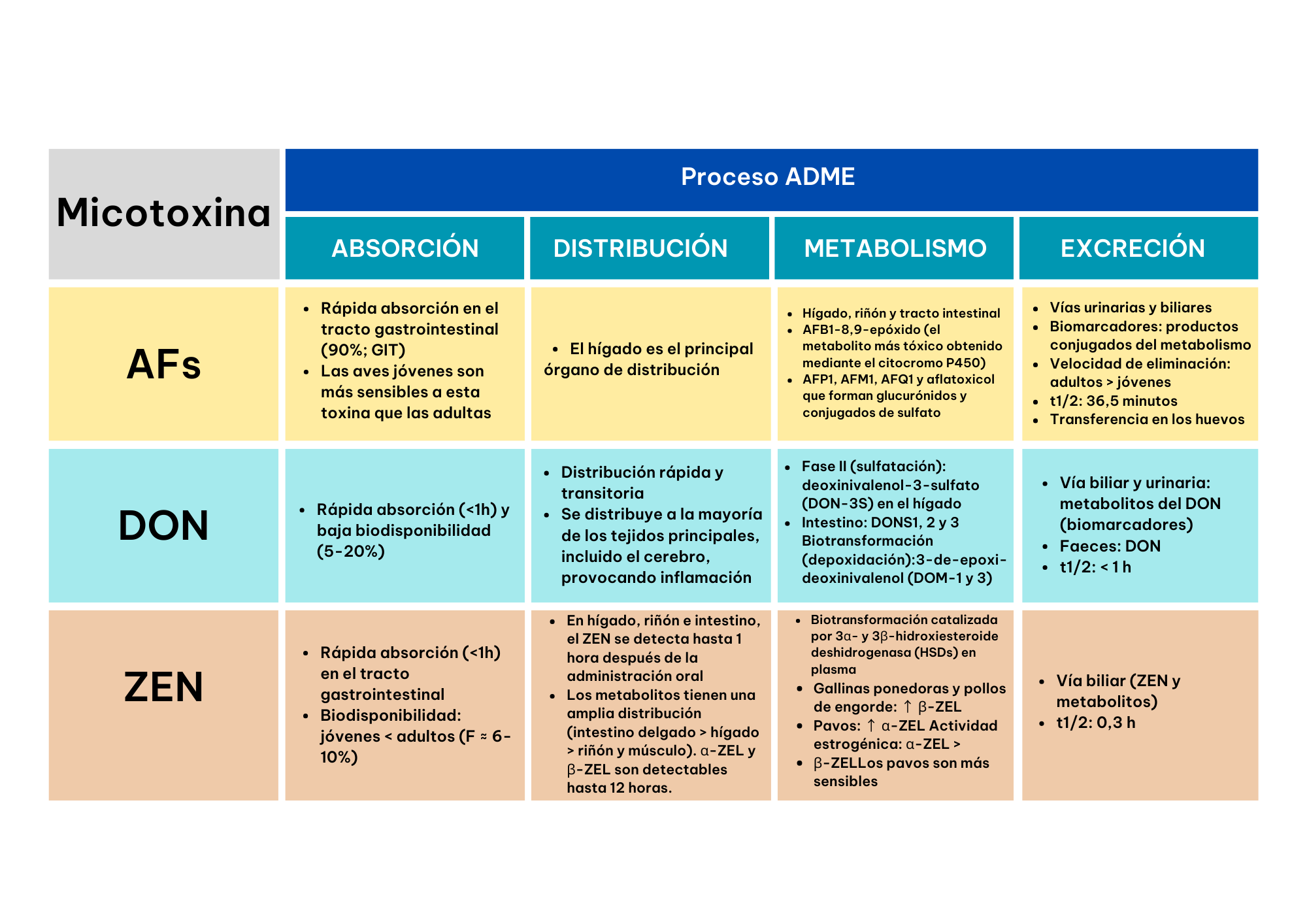
Las aflatoxinas son altamente absorbidas en el tracto gastrointestinal de las aves (90%).Destacan por su efecto cancerígeno que puede afectar a cualquier órgano o sistema, especialmente al hígado y el riñón.
Distribución
El sitio de elección de las AFs es el hígado (Schrenk et.al, 2020). Las aves con aflatoxicosis se ven drásticamente afectadas en la composición de ácidos grasos a nivel hepático, incrementando el nivel de peroxidación de lípidos, que conlleva la generación de estrés oxidativo y disminución de antioxidantes enzimáticos y no enzimáticos (Allah et. al, 2018).
Metabolismo
La biotransformación de aflatoxinas tiene lugar en el hígado, riñón y tracto intestinal. Los productos de biotransformación son menos tóxicos que la AFB1, excepto AFB1-8,9-époxido, que se obtiene a partir del citocromo P450. Otros metabolitos son el AFP1, AFM1, AFQ1 y aflatoxicol que forman glucorónidos y conjugados de sulfato. Los pavos son muy sensibles a las AFB1 que los pollos (Coppock et.al, 2018). De hecho, entre las especies avícolas, los animales jóvenes y los pavos son los más sensibles.
Excreción
Las aflatoxinas se excretan por vía urinaria, huevos, bilis y heces (Coppock et.al, 2018). Se ha demostrado que la eliminación de la AFB1 de los tejidos es más rápida en animales adultos que en animales jóvenes (Hussain et.al, 2010). La vida media plasmática es de 36,5 minutos (Allah et.al, 2018).
Deoxinivalenol (DON)
Absorción
La absorción de esta micotoxina es rápida (Schrenk et al., 2023), con un tiempo máximo de 1 h (Sun et al., 2022). En aves, su biodisponibilidad es baja y oscila entre el 5% y el 20% (Schrenk et al., 2023).
Distribución
En aves el DON presenta una amplia distribución en muchos de los tejidos (Schrenk et.al, 2023). Su distribución es rápida y transitoria en tejidos como: suero, músculo, grasa abdominal, estómago, intestino, hígado, riñones, corazón, cerebro, pulmón, piel, bazo, testículos, ovarios y glándulas suprarrenales (Devreese et al., 2015).
Metabolismo
Los procesos de sulfatación y desoxidación representan las principales rutas metabólicas de esta micotoxina, dando lugar a metabolitos con una toxicidad notablemente reducida. Se observa una amplia sulfatación en el hígado e intestino, siendo el metabolito predominante el 3-sulfato DON (DON-3S). Además, se lleva a cabo una desepoxidación eficiente del DON a DOM-1 y DOM-3 en el intestino, con una sensibilidad comparativamente menor en aves de corral. Otros derivados intestinales incluyen los sulfonatos DONS1, 2 y 3 (Schwartz et al., 2015).
Excreción
Esta micotoxina presenta una rápida eliminación del organismo. Los metabolitos del DON son excretados vía bilis, orina y una pequeña cantidad de DON sin modificar, se puede encontrar en las heces. El tiempo medio de eliminación en plasma inferior a 1 h (Schrenk et.al, 2023).
Zearalenona (ZEA)
Absorción
Esta micotoxina se absorbe rápidamente en pollos, gallinas ponedoras y pavos, generalmente dentro de un intervalo de tiempo que varía entre 5 minutos y 2 h (Liu y Applegate, 2020). Algunos autores han señalado una baja biodisponibilidad en animales más jóvenes (Liu y Applegate, 2020). Además, Devreese et al. (2015) observaron una biodisponibilidad del 6,87% al 10,2%.
Distribución
Los metabolitos de ZEA, α-ZEL y β-ZEL, pueden ser identificados en diversos tejidos y fluidos corporales, incluyendo sangre, hígado, riñón, músculo, intestino y heces (Buranatragool et al., 2015). Después de la administración oral, ZEA se puede detectar en el hígado, riñón e intestino delgado hasta 1 h después su ingestión, mientras que α-ZEL y β-ZEL permanecen detectables en esos mismos órganos durante un máximo de 12 h (Devreese et al., 2015). Además, tanto ZEA como sus metabolitos se pueden encontrar en el músculo hasta 1 h después de la exposición (Devreese et al., 2015).
Metabolismo
En broilers, ZEA se transforma rápidamente en α-ZEL y β-ZEL en plasma. Ponedoras y broilers muestran una biotransformación predominante de ZEA a β-ZEL, mientras que, en pavos, ZEA se convierte preferentemente en α-ZEL y tendrán una mayor sensibilidad (Liu y Applegate, 2020).
Excreción
En aves, se ha identificado la bilis como una ruta de excreción importante para ZEA y sus metabolitos, lo que sugiere que la principal vía de eliminación es mediante las heces. Además, en estudios realizados en broilers, pavos y ponedoras, se estima que la vida media de ZEA es de aproximadamente 0,3 h (Knutsen et al., 2021).
Ocratoxina A (OTA)
Absorción
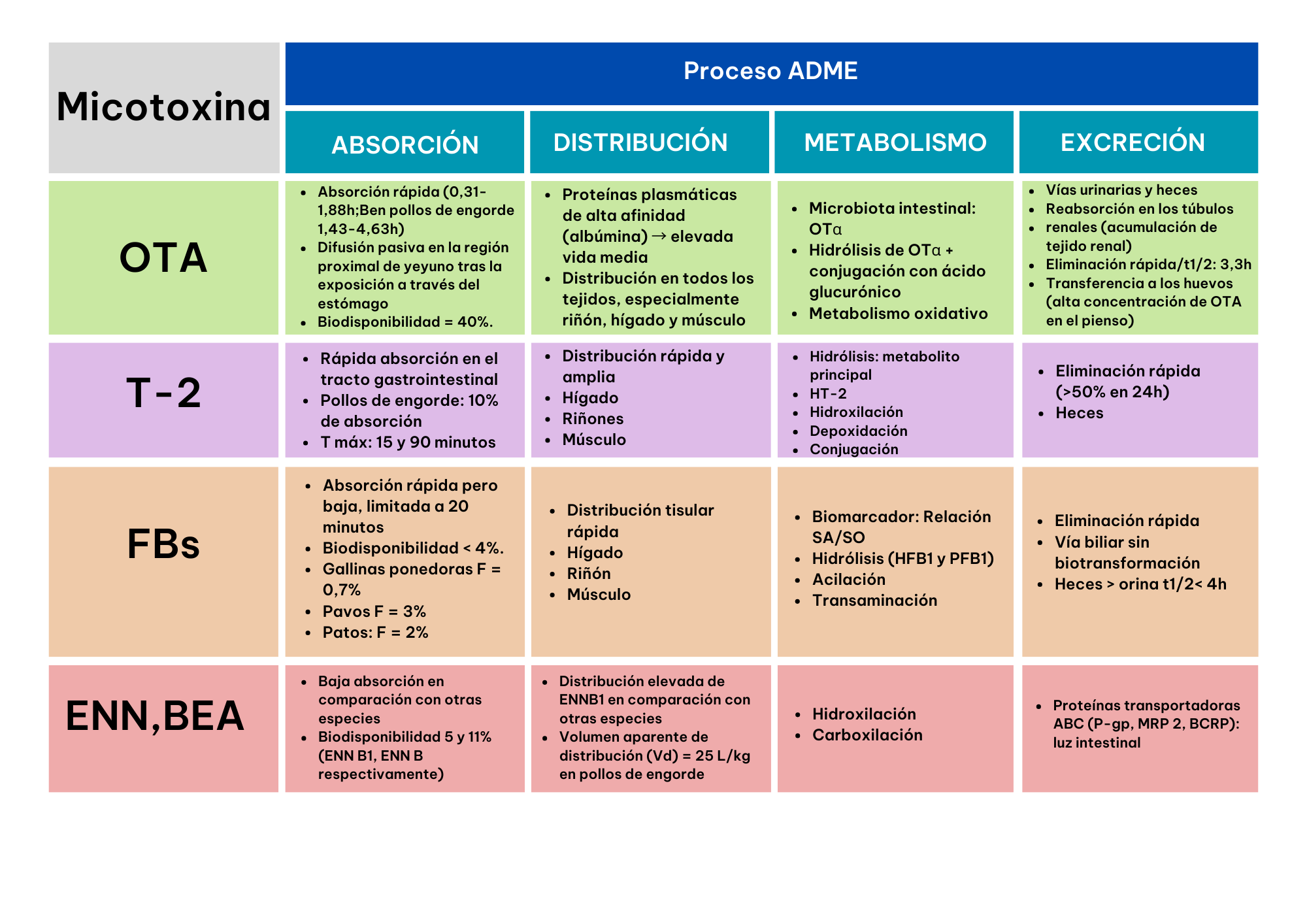
Las aves muestran una rápida absorción y una elevada concentración de OTA en la sangre durante un período de varias horas. Este proceso se lleva a cabo principalmente a través de la difusión pasiva, particularmente en la región proximal del yeyuno, después de la exposición a través del estómago. En pollos, se estima que la biodisponibilidad alcanza el 40% (Schrenk et al., 2020). En un estudio realizado por Devreese et al. (2018), se observó que la absorción de OTA es rápida, con un tiempo máximo de entre 0,31 y 1,88 h en gallinas ponedoras, pavos y patos. En pollos de engorde, este tiempo máximo se extiende a 1,43-4,63 h.
Distribución
La OTA se distribuye en todos los órganos, pero es más prevalente en el riñón, hígado y músculo. (Shrenk et.al, 2020).
Metabolismo
El mayor metabolito de OTA es OTalpha (OTα), generado por la microbiota intestinal en monogástricos. OTα se absorbe parcialmente en el intestino, pero no se acumula en el riñón; en su lugar, se excreta rápidamente a través de la orina en forma de glucurónido. La vía metabólica predominante implica la hidrólisis de OTα seguida de su conjugación con ácido glucurónico, siendo el metabolismo oxidativo de menor relevancia (Schrenk et al., 2020).
Excreción
La OTA se elimina y excreta lentamente debido a la unión a proteínas plasmáticas las que presentan una baja tasa de metabolismo. Asimismo, se ha descrito que hay una reabsorción de OTA secretada y filtrada por el riñón que conlleva a una acumulación en el tejido renal, retrasando su excreción (Shrenk et. al, 2020).
El proceso de excreción de OTA y sus metabolitos tiene lugar mediante la orina y las heces. Las aves eliminan OTA más rápido que los mamíferos monogástricos, lo que resulta en un menor acúmulo de ocratoxina.
La transferencia de OTA al huevo ocurre cuando su concentración en el alimento es alta, como 10 mg/kg por kg de peso vivo (Schiavone et. al, 2008; Battacone et. al, 2010). Ruprich et.al (1991) encontró que la vida media de eliminación es de 3,3 h.
Toxina T-2 (T-2)
Absorción
La toxina T-2, al igual que otros tricotecenos, se absorbe rápidamente en el tracto intestinal, experimentando una metabolización y eliminación del 80-90% en un plazo de 48 h (Sokolovic et al., 2008). Broekaert et al. (2014) informaron una absorción del 10,6% solamente en pollos broiler después de la administración de 0,5 mg/kg de peso vivo. La máxima absorción de T-2 se observa a los 15 y 90 minutos posteriores al consumo de alimentos contaminados (Reddy et al., 2004).
Distribución
La toxina T-2 se distribuye ampliamente y rápidamente al igual que en las otras especies. En un estudio, las concentraciones máximas de toxina T-2 y sus metabolitos se observaron a las 3 h en el hígado y riñones y a las 4-6 h en el hígado, músculo y riñones (Chi et.al, 1978).
Metabolismo
La toxina T-2 es generalmente metabolizada y eliminada después de la ingestión, con más de 20 metabolitos (HT-2 es el principal). Las reacciones metabólicas principales son: hidrólisis, hidroxilación, desepoxidación y conjugación (CONTAM, 2011).
Excreción
Esta micotoxina se elimina rápido (más del 50% en 24 h) y principalmente por las heces (CONTAM, 2011).
Fumonisinas (FBs)
Absorción
En el caso de las FBs, su absorción es alrededor del 2-3%, de modo que el tracto gastrointestinal es uno de los órganos diana principal de esta micotoxina. (Knutsen et.al, 2018). La absorción es rápida, pero limitada a 20 minutos tras la administración del alimento (Knutsen et.al, 2018). Los pavos y los patos son más sensibles a estas micotoxinas que las gallinas ponedoras y reproductoras.
Distribución
Se distribuye rápidamente en los tejidos y se encuentra principalmente en hígado, riñón y músculo (Knutsen, et al., 2018).
Metabolismo
El metabolismo de las FBs incluye reacciones de hidrólisis (las formas hidrolizada, HFB1 y parcialmente hidrolizadas, PFB1), acilación y transaminación en el hígado (Hartinger et al., 2011). Dado la alta similitud estructural con los esfingolípidos, el desequilibrio en la relación esfinganina/esfingosina se considera un biomarcador de gran interés para determinar la toxicidad de las fumonisinas (Guerre et al., 2022).
Excreción
Las FBs se excretan por vía biliar sin biotransformación y presentan una mayor eliminación en las heces (generalmente el 90% de la dosis) que por la vía urinaria. En las heces se han detectado tanto las FBs y sus metabolitos, con una vida media inferior a 4h (Knutsen, et al., 2018).
Micotoxinas emergentes
Las micotoxinas emergentes se refieren a un grupo de micotoxinas que presentan una estructura distinta a las mencionadas anteriormente y por las que, hasta la fecha, no existe ninguna regulación, e incluyen fusaproliferina, beauvericina, enniatinas y moniliformina, todas producidas por el género Fusarium (Krska et al., 2015).
Eniantina y Beauvericina
Absorción
En aves, las micotoxinas emergentes presentan poca absorción a diferencia de otras especies, con una biodisponibilidad (F) de 5% y 11% para la ENN B1 y B, respectivamente.
Distribución
La ENN B1 presenta una elevada distribución en los tejidos en pollos (Fraeyman et al., 2016). El volumen de distribución es de 25 L/kg en pollos de engorde.
Metabolismo
El metabolismo de estas micotoxinas incluye reacciones de hidroxilación y carboxilación (Ivanova et al., 2011).
Excreción
Estas micotoxinas se eliminan mediante proteínas transportadoras ABC (P-gp, MRP 2, BCRP) directamente al lumen intestinal. En pollos se ha descrito una elevada eliminación en comparación con otras especies. Además, hay que tener en cuenta que la baja biodisponibilidad y la alta eliminación de las eniantinas en aves, hace que la toxicidad provocada por estas micotoxinas en estas especies sea muy baja.
Conclusiones
El estudio de los procesos implicados en la toxicocinética permite llevar a cabo la evaluación de la susceptibilidad de especies de destino y a sus diferentes categorías a las diferentes micotoxinas en nutrición animal.
Tabla 1. Toxicocinética de micotoxinas comunes y emergentes en la producción animal